编者按:2021欧洲心脏病学会(ESC)年会的“Hot line”专场上,非奈利酮面向2型糖尿病(T2DM)合并慢性肾脏病(CKD)患者开展的第二个大型Ⅲ期临床研究FIGARO-DKD结果正式发表。本刊特邀南方医科大学南方医院内分泌代谢科薛耀明教授解读,与各位同道共同深入学习。
研究背景
CKD会加重与T2DM相关的心血管风险[1]。当患者的尿白蛋白肌酐比(UACR)>10 mg/g,估算肾小球滤过率(eGFR)<75 ml/min/1.73 m2时,其心血管事件和新发心力衰竭的风险就会增加[2]。大多数CKD患者发生心血管事件的风险高于肾衰竭[3]。因此,诊断和治疗CKD对于降低T2DM患者心血管和心力衰竭的高负担非常重要[4]。
盐皮质激素受体过度激活与肾脏和心血管疾病有关,这些疾病通常以心肾疾病并存。非奈利酮作为一种选择性非甾体盐皮质激素受体拮抗剂,在临床前模型和针对CKD患者的Ⅱ期临床研究中能改善肾脏和心血管损伤的标志物。非奈利酮的Ⅲ期临床研究包括两个互补的研究,这两个研究共同覆盖了T2DM合并CKD的大部分患者。在此前已发表的非奈利酮降低糖尿病肾脏病(DKD)肾衰竭和疾病进展(FIDELIO-DKD)研究结果中,非奈利酮显著改善了T2DM伴CKD 3-4期合并大量白蛋白尿患者的肾脏结局,这是一个肾脏风险较高的人群。在本次发布的非奈利酮降低DKD心血管死亡率和发病率(FIGARO-DKD)的研究中,目标人群聚焦于CKD 2-4期合并中度白蛋白尿的患者或CKD 1-2期合并大量白蛋白尿患者。
研究方法
FIGARO-DKD研究是一项多中心、随机、双盲、安慰剂对照、双盲、事件驱动的Ⅲ期临床研究,主要纳入人群为合并CKD的T2DM患者。研究共纳入7437名受试者(UACR 30-<300 mg/g 且eGFR 25-≤90ml/ min/1.73 m2或UACR ≥300-≤5000mg/g且eGFR≥60ml/ min/1.73 m2),按1:1比例随机分配至非奈利酮治疗组和安慰治疗组。其中对于eGFR<60ml/ min/1.73 m2的受试者起始剂量为10mg q.d.,eGFR≥60ml/ min/1.73 m2的受试者起始剂量为20mg q.d.。第1个月后,非奈利酮或安慰剂的目标剂量为20mg q.d.; 在血清钾水平不超过4.8 mmol/l且eGFR稳定的情况下,建议将剂量从10 mg q.d.调整至20 mg q.d.; 在开始非奈利酮或安慰剂后,出于任何安全原因可将剂量从20mg q.d.降至10mg q.d.。在随机后1个月、4个月及随后每4个月对受试者进行随访,直至研究结束。研究主要结局为心血管死亡、非致死性心肌梗死、非致死性卒中或因心力衰竭住院的心血管复合终点。第一次要结局为首次发生肾衰竭、eGFR相对基线持续下降≥40%或因肾脏疾病导致的死亡的肾脏复合终点。
FIGARO-DKD的研究设计方案详见图1,FIGARO-DKD和FIDELIO-DKD纳入人群的异同详见图2。
图1 FIGARO-DKD研究设计图
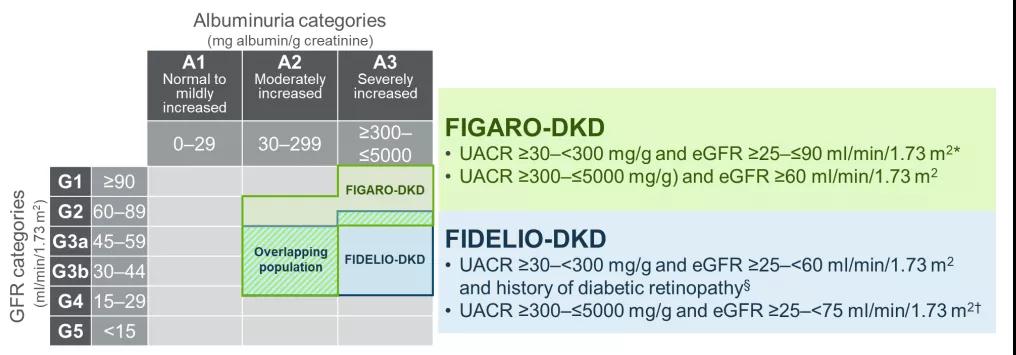
图2 FIGARO-DKD和FIDELIO-DKD纳入人群的异同
研究结果
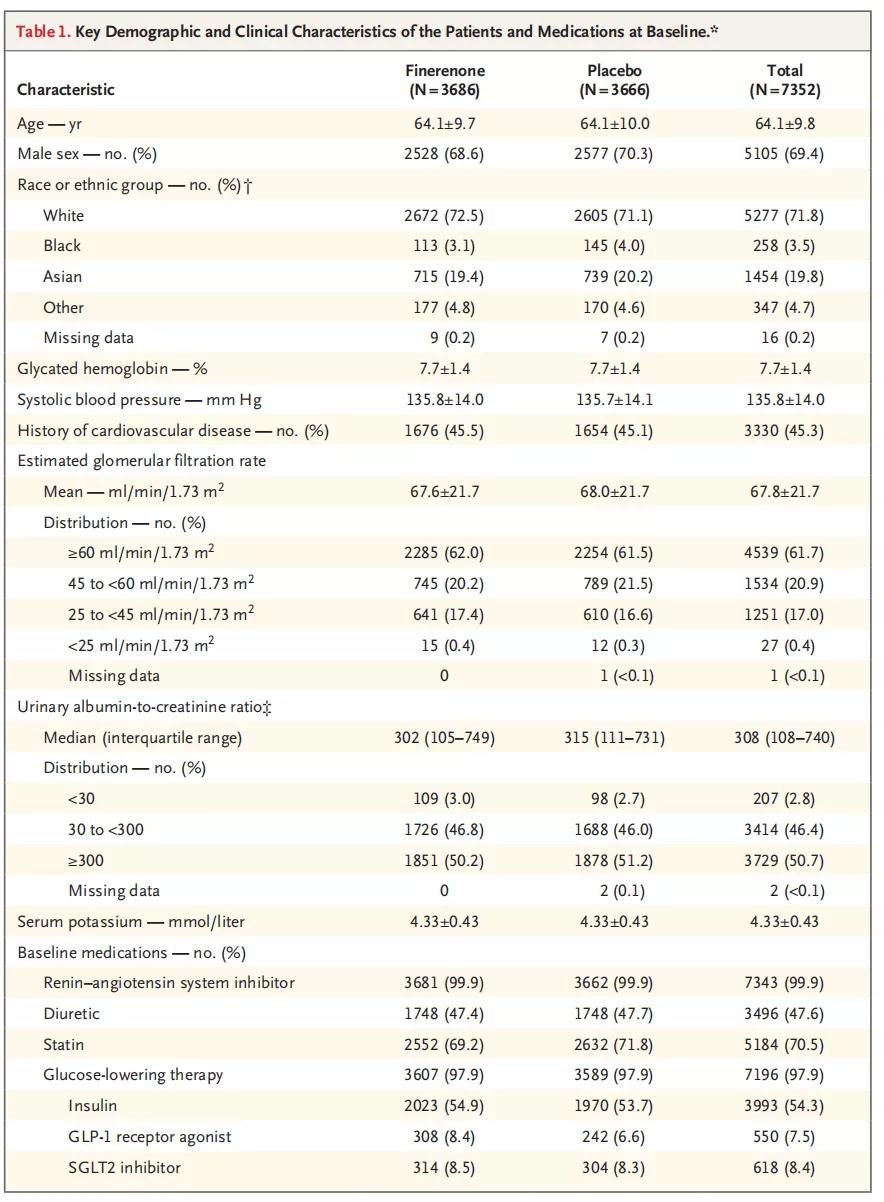
自2015年9月至2018年10月,来自48个国家共19381名患者经过筛选,7437名受试者参与随机,排除85名违背临床规范的数据后,最终对7352名受试者的数据进行分析,其中非奈利酮治疗组3686例,安慰剂对照组3666例,两组受试者基线时特征一致。具体基线资料详见表1)
表1 基线时受试者的主要人口学和临床特征
心血管结局
在中位随访3.4年间,非奈利酮每日平均剂量为17.5 mg,安慰剂为18.2 mg。非奈利酮组共458例(12.4%)患者发生主要心血管结局事件,而对照组为519例(14.2%) (HR=0.87;95%CI:0.76~0.98;P=0.03;图3),差异主要来自于心脏衰竭住院的发生率在非奈利酮组显著降低(HR=0.71; 95% CI:0.56~0.90;图4)
图3 非奈利酮与安慰剂组心血管复合终点事件发生率
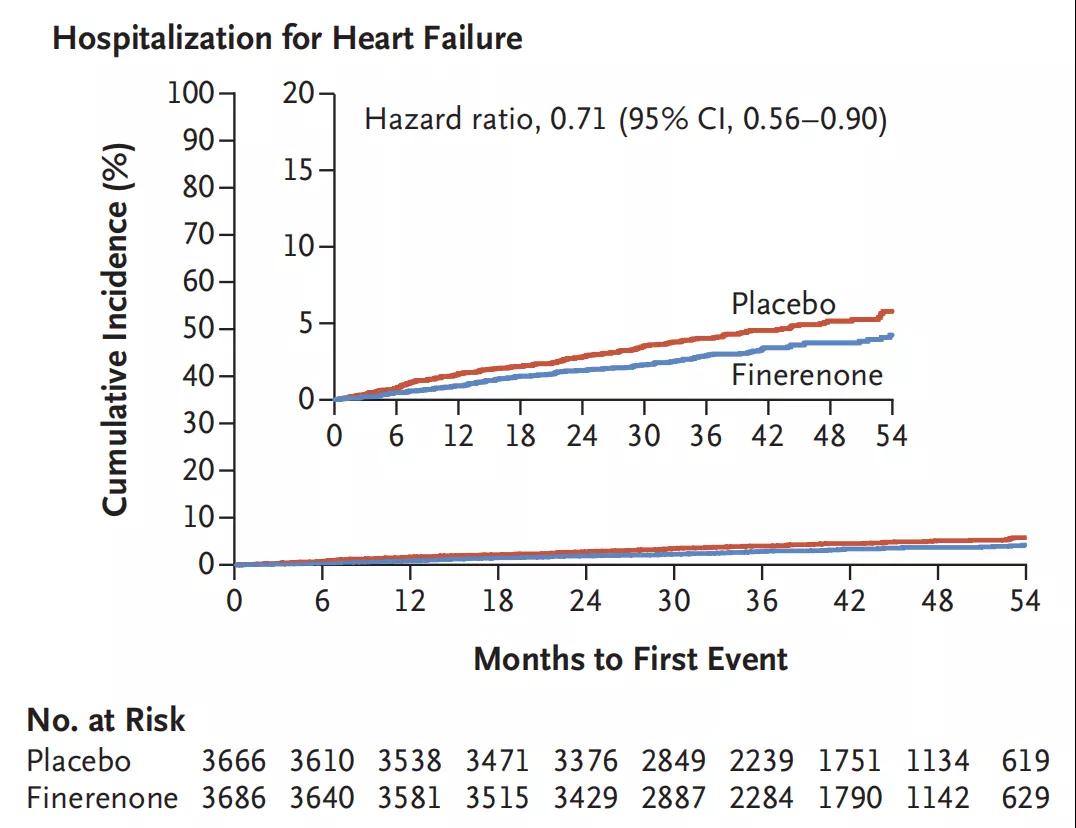
图4 非奈利酮与安慰剂组因心衰住院的发生率
肾脏结局
尽管非奈利酮对次要研究终点中eGFR相对基线持续下降≥40%的肾脏复合结局没有显著改善(HR=0.87;95%CI: 0.76~1.01;图5);但对eGFR相对基线持续下降≥57%的肾脏复合重点有显著改善(HR=0.77;95%CI:0.60~0.99;P=0.0046;图6)。
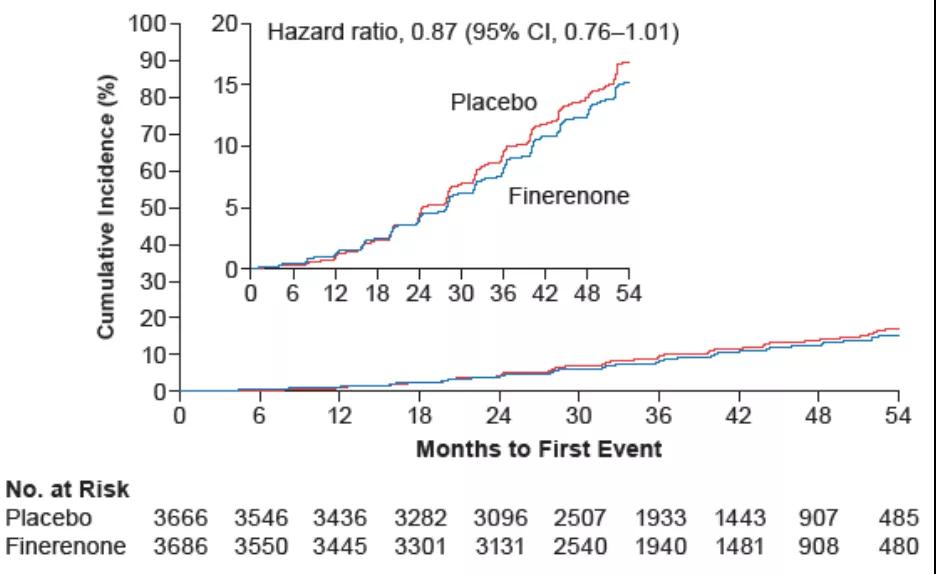
图5 非奈利酮与安慰剂组中eGFR相对基线持续下降≥40%的复合终点事件发生率
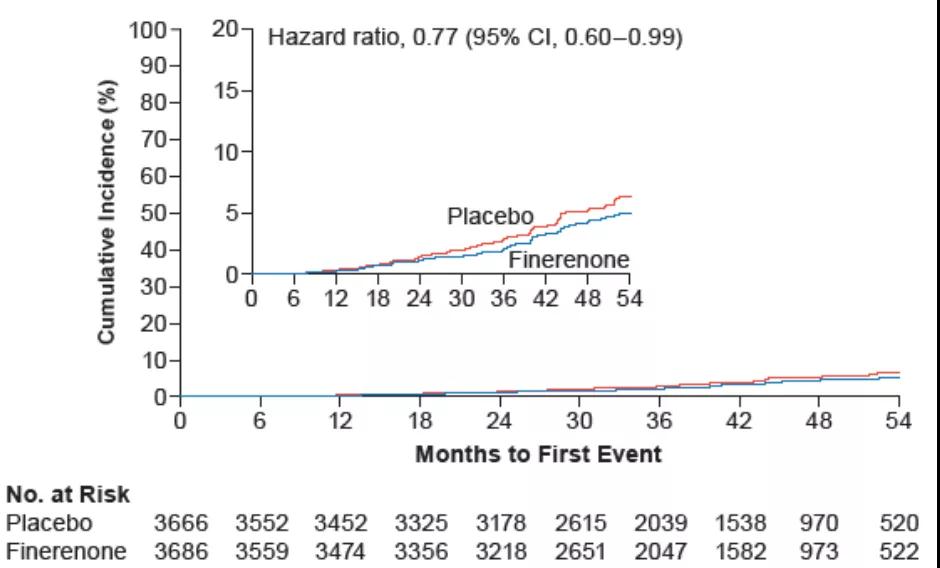
图6 非奈利酮与安慰剂组中eGFR相对基线持续下降≥57%的复合终点事件发生率
安全性结局
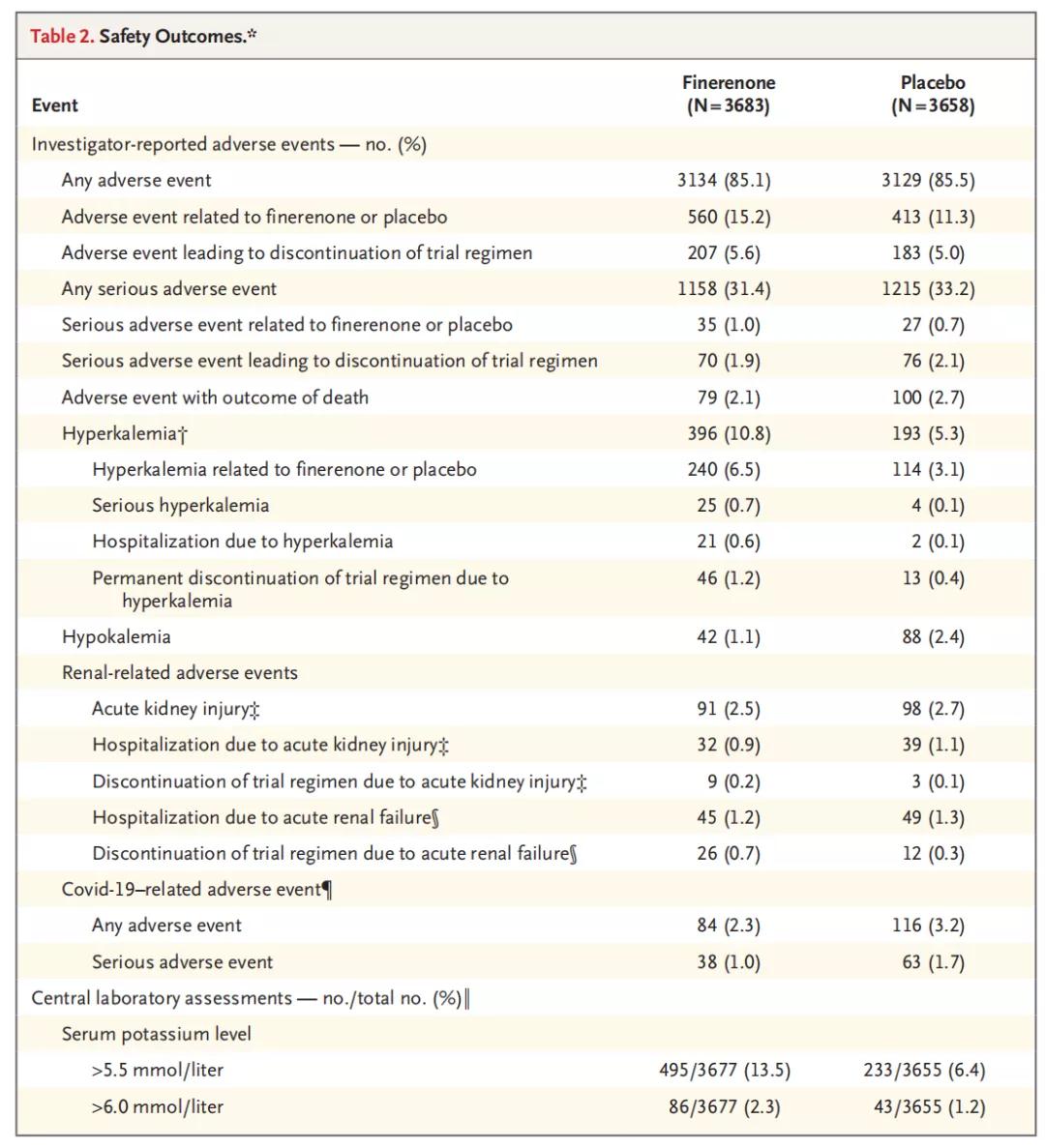
尽管非奈利酮组高钾血症相关停药的发生率(1.2%)高于安慰剂组(0.4%),不良事件的总体发生率在组间没有显著差异(表2)。
表2 安全性结局
研究解读
随着病程的延长,T2DM患者往往会合并多种并发症,其中DKD是糖尿病最常见的并发症之一,约有40%的T2DM患者合并有DKD[5]。对于合并有DKD的T2DM患者,其心血管疾病的发病率及死亡率均会上升,且大部分DKD患者死于心血管疾病而非终末期肾脏病(ESRD)[6]。因此,临床医生在诊治T2DM的过程中,不仅要关注患者的肾脏损害,还需对心血管风险进行评估和干预。以往针对心血管疾病的治疗策略多基于正常肾功能患者,而在肾功能正常的患者中有效的治疗策略不一定对DKD患者同样适用。
目前常用的盐皮质激素受体拮抗剂包括螺内酯(第一代)和依普利酮(第二代)。在RAAS 阻断剂基础上加用盐皮质激素受体拮抗剂可有效控制血压并降低白蛋白尿,但需要注意高钾血症、急性肾功能受损及男性乳房发育的风险。非奈利酮作为第三代盐皮质激素受体拮抗剂对盐皮质激素受体具有更高的选择性和亲和力,在降低CKD患者的白蛋白尿同时不增加包括高钾血症在内的不良事件的风险。
以前的试验中已经针对T2DM合并不同程度CKD患者的心血管结果进行了研究,但仍然缺乏来自专门临床试验的证据来支持使用治疗方法来改善晚期CKD患者的心肾结果。FIDELIO-DKD研究[7]和FIGARO-DKD研究[8]结果的发布,为非奈利酮应用于轻中重度DKD患者提供了强有力的证据,证实了在标准治疗基础上添加非奈利酮不但能延缓肾功能的减退,还能降低心血管相关死亡及心衰住院的发生,为患者带来心肾获益。
在本试验中,非奈利酮治疗的心血管益处在不同基线UACR和eGFR亚组是一致的。超过60%的患者出现蛋白尿时的基线eGFR>60ml/min /1.73 m2,这提示了对T2DM患者需同时进行eGFR及白蛋白尿的筛查,以及在这一心血管高风险患者群体中进行“诊断-分期-评估-防治”的一体化诊疗模式[9],以改善DKD患者的预后。
专家简介
薛耀明教授 医学博士,博士生导师,现任南方医科大学南方医院内分泌代谢科主任,担任中华医学会糖尿病学分会常委及微血管并发症学组组长、广东省医学会糖尿病分会主委、中国医师协会内分泌代谢科医师分会常委、中国微循环学会糖尿病与微循环分会糖尿病足病学组组长、广东省中西医结合学会创面处理专业委员会主委、广东省医学会内分泌分会常委,担任《中华内分泌代谢科杂志》、《中华糖尿病杂志》《中国糖尿病杂志》、《国际内分泌杂志》编委。美国哈佛大学医学院Joslin糖尿病中心客座教授。主持国家自然科学基金和广东省重点科技项目共20余项,累计科研经费500万元,发表SCI论文近30篇,先后获省部级科技奖励6次,获得一项国家发明专利。2021年牵头制定《中国糖尿病肾脏病防治指南(2021年版)》,并在《中华糖尿病杂志》和《国际内分泌代谢杂志》同步发表。
王翔宇博士 南方医科大学南方医院内分泌代谢科博士后。2021年毕业于南方医科大学临床医学(八年制)。在攻读博士学位及博士后期间参与了多项针对糖尿病肾病发病机制的基础研究,发表SCI文章1篇,中文核心期刊2篇。
▼参考文献
[1] Gansevoort RT, Correa-Rotter R, Hemmelgarn BR, Jafar TH, Heerspink HJ, Mann JF, Matsushita K, Wen CP. Chronic kidney disease and cardiovascular risk: epidemiology, mechanisms, and prevention. Lancet. 2013 Jul 27;382(9889):339-52.
[2] Fox CS, Matsushita K, Woodward M, Bilo HJ, Chalmers J, Heerspink HJ, Lee BJ, Perkins RM, Rossing P, Sairenchi T, Tonelli M, Vassalotti JA, Yamagishi K, Coresh J, de Jong PE, Wen CP, Nelson RG; Chronic Kidney Disease Prognosis Consortium. Associations of kidney disease measures with mortality and end-stage renal disease in individuals with and without diabetes: a meta-analysis. Lancet. 2012 Nov 10;380(9854):1662-73.
[3] Eriksen BO, Ingebretsen OC. The progression of chronic kidney disease: a 10-year population-based study of the effects of gender and age. Kidney Int. 2006 Jan;69(2):375-82.
[4] Ruilope LM, Agarwal R, Anker SD, Bakris GL, Filippatos G, Nowack C, Kolkhof P, Joseph A, Mentenich N, Pitt B; FIGARO-DKD study investigators. Design and Baseline Characteristics of the Finerenone in Reducing Cardiovascular Mortality and Morbidity in Diabetic Kidney Disease Trial. Am J Nephrol. 2019;50(5):345-356.
[5] Afkarian M, Zelnick LR, Hall YN, Heagerty PJ, Tuttle K, Weiss NS, de Boer IH. Clinical Manifestations of Kidney Disease Among US Adults With Diabetes, 1988-2014. JAMA. 2016 Aug 9;316(6):602-10.
[6] Thompson S, James M, Wiebe N, Hemmelgarn B, Manns B, Klarenbach S, Tonelli M; Alberta Kidney Disease Network. Cause of Death in Patients with Reduced Kidney Function. J Am Soc Nephrol. 2015 Oct;26(10):2504-11.
[7] Bakris GL, Agarwal R, Anker SD, Pitt B, Ruilope LM, Rossing P, Kolkhof P, Nowack C, Schloemer P, Joseph A, Filippatos G; FIDELIO-DKD Investigators. Effect of Finerenone on Chronic Kidney Disease Outcomes in Type 2 Diabetes. N Engl J Med. 2020 Dec 3;383(23):2219-2229.
[8] Pitt B, Filippatos G, Agarwal R, Anker SD, Bakris GL, Rossing P, Joseph A, Kolkhof P, Nowack C, Schloemer P, Ruilope LM; FIGARO-DKD Investigators. Cardiovascular Events with Finerenone in Kidney Disease and Type 2 Diabetes. N Engl J Med. 2021 Aug 28.
[9] 中华医学会糖尿病学分会微血管并发症学组.中国糖尿病肾脏病防治指南(2021年版)[J].中华糖尿病杂志, 2021, 13(8): 762-784. DOI: 10.3760/cma.j.cn115791-20210706-00369.